Доктор медицины Michael L. Schulster (1) и доктор медицины David S. Goldfarb (2)
(1) Отделение урологии, Нью-Йоркский университет Langone Health
(2) Отделение нефрологии, Нью-Йоркский университет Langone Health, Школа медицины Нью-Йоркского университета и Система здравоохранения Нью-Йорк-Харбор VA, Нью-Йорк, штат Нью-Йорк, США
Ключевые слова: кальций; камни, почки; холекальциферол; хроническая болезнь почек – минеральные и костные заболевания; нефролитиаз; уролитиаз
Резюме
В этом обзоре рассматривается связь между приемом витамина D и риском камнеобразования. Несмотря на многочисленные исследования, демонстрирующие, что терапевтические дозы витамина D не увеличивают риск образования камней, авторами высказано предположение о наличии причинно-следственной связи. Некоторые пациенты с уже присутствующим анамнезом образования камней могут подвергаться повышенному риску рецидива при приеме витамина D, возможно, из-за мутаций гена CYP24A1. Кроме того, фактических данных о том, кому не хватает витамина D, и о пользе добавок для тех, кто не подвержен риску рахита, немного. Риска можно избежать, причем скрининг уровня витамина D большинству пациентов не требуется, и существуют превосходные фармакологические препараты, которые увеличивают плотность костей и уменьшают риск образования камней.
Введение
В этом обзоре мы рассматриваем взаимосвязь между витамином D и риском камнеобразования и предлагаем альтернативы для пациентов с мочекаменной болезнью, которым требуется фармакологическое вмешательство для поддержания здоровья костей. Самое последнее Национальное обследование состояния здоровья и питания (НОСЗП) сообщает, что распространенность камней в почках в США почти утроилась с 1980 года. Частота возникновения камней у жителей США (хотя бы один эпизод за жизнь) в настоящее время составляет 8,8%, эта патология чаще встречается среди мужчин, хотя женщины сокращают разрыв.1
Кальциевые камни на сегодняшний день являются наиболее распространенным типом нефролитиаза, составляя более 85% от всех случаев.2 Почечные камни напрямую связаны с повышенным индексом массы тела, прибавлением веса, диабетом1, а также с диетами, богатыми животным белком и натрием, в то же время они обратно связаны с потреблением жидкости, калия и пищевого кальция.2 Более высокое выделение кальция с мочой является значительным фактором риска для образования камней в почках и связано с низкой минеральной плотностью кости (МПК)3 и переломами.4
Учитывая то, что всасывание кальция в кишечнике приводит к значительному повышению случаев кальциурии у людей, склонных к образованию камней,5 существует теоретический риск того, что добавка витамина D может увеличить его всасывание в кишечнике и литогенез. Последние данные не выявили риска образования камней в почках при повышенном употреблении витамина D в общей популяции.6 Однако, остается открытым вопрос о том, приводит ли прием витамина D или его повышенный уровень в сыворотке к образованию камней у людей, которые уже имели камни в анамнезе, или у генетически предрасположенных подгрупп. Дефицит витамина D оказался связан с широким спектром заболеваний, и как следствие, в последнее время наблюдается всплеск тестирования его уровня и назначения.7
Выявляемое совпадение между частыми приемами витамина D и более высокой распространенностью камней в почках явилось поводом для выявления причинно-следственных связей. Этот вопрос имеет большое значение, поскольку преимущества скрининга уровня витамина D и его дополнительный прием в случае, если значения низкие, по-видимому, дают мало пользы даже для людей с пониженной минеральной плотностью кости.
Генез кальциевых камней почек
Образование кальциевого камня представляет собой сложный физиологический процесс, широко исследуемый с помощью нескольких предполагаемых механистических моделей, подробности которых выходят за рамки данного обзора. Хотя многое до сих пор неизвестно, значительными предпосылками для формирования камня являются более высокое перенасыщение, кристаллизация, рост и агрегация. Сложные химические параметры мочи, такие как рН, полиионное содержание, накопление промоторов и ингибиторов, также вносят свой вклад. Распространенными мочевыми изменениями у пациентов с кальциевыми камнями является более высокая экскреция кальция с мочой, объяснение которой часто не находится. Говорят, что такие пациенты имеют идиопатические кальциевые камни. Генетические факторы, несомненно, важны, но вовлеченные гены не в полной мере объясняют наличие значимой наследственности.
Поскольку большинство камней состоит из кальция, его метаболизм и пищевые механизмы контроля представляют большой интерес. Важно отметить, что ограничение потребления кальция не уменьшает частоту образования камней. Фактически ограничение потребления кальция с пищей увеличивает литогенные факторы мочи и может привести к деминерализации костей2, явление, которое оказалось более выраженным у лиц, склонных к образованию камней, среди тех пациентов, которые уже находятся в группе риска из-за нехватки витамина D,8 уменьшенного МПК и переломов4. Curhan с соавторами в большом проспективном исследовании обнаружили обратную зависимость между потреблением кальция и риском образования камней в почках.2
Авторы предположили, что прием кальция связывает пищевой оксалат, снижая его всасывание в кишечнике и затем экскрецию с мочой. С другой стороны, прием кальциевых добавок приводит с повышенному риску образования камней. Отказ от приема пероральных добавок с кальцием одновременно с пищевым оксалатом может служить объяснением данных противоречий. Вероятно, стоит создать рекомендации по употреблению кальциевых добавок определенного состава, так как цитрат кальция может быть менее литогенным, чем карбонат кальция.9 Витамин D является неотъемлемой частью гомеостаза кальция и костного метаболизма, но специалисты расходятся во мнении по поводу необходимости, безопасности и эффективности его назначения при различной плотности костей, как пациентам, склонным к камнеобразованию, так и не склонным.
Метаболизм витамина D
Витамин D является жирорастворимым витамином, неактивным в своей естественной форме, и получаемым значительно и эффективно при стимуляции солнечным светом синтеза в коже и в меньшей степени из рациона. Витамин D подвергается гидроксилированию в печени под действием 25-гидроксилазы (CYP2PR1), в результате чего образуется 25-гидроксивитамин D3. Последующее гидроксилирование, в основном в почках, 1α-гидроксилазой (CYP27B1) приводит к выработке биоактивной формы 1,25-дигидроксивитамина D3 (кальцитриол). Кальцитриол связывается с внутриклеточными рецепторами в тканях-мишенях, способствуя транскрипции множества соответствующих генов. Основной функцией кальцитриола является содействие усвоению кальция в кишечнике. Однако он также непосредственно подавляет выброс паратиреоидного гормона (ПТГ), способствует абсорбции фосфатов в почках и кишечнике, а также регулирует функцию остеобластов и резорбцию кости.
24-гидроксилаза (CYP24A1) дезактивирует 1,25-дигидроксивитамин D3 до кальцитроевой кислоты. (Рисунок 1) Он также действует на предшественник 25-гидроксивитамин D3 под контролем нескольких механизмов отрицательной обратной связи, чтобы предотвратить его преобразование в активную форму. Этот дезактивирующий фермент (подробно обсуждаемый ниже) может играть ключевую роль у пациентов с нефрокальцинозом и камнями почек, особенно в условиях приема витамина D.10
Поскольку витамин D непосредственно стимулирует всасывание кальция в кишечнике, он был тщательно изучен с целью определения, увеличивает ли его повышенный уровень экскрецию кальция с мочой и способствует ли образованию кальциевых камней. В проспективно наблюдаемых когортах мужчин и женщин уровни кальцитриола были повышены у пациентов, склонных к камнеобразованию, и независимо ассоциировались с более высоким риском развития камней в почках. При этом уровни кальция и ПТГ в сыворотке не были связаны с камнеобразованием.11 Кроме того, кетоконазол, мощный ингибитор синтеза витамина D (через 1α-гидроксилазу, CYP27B1), (Рисунок 1) эффективно снижал сывороточный кальцитриол и кальций в моче у некоторых, но не у всех пациентов с более высокой экскрецией кальция с мочой.12 В то время как содержание кальция в моче пропорционально увеличивается с кишечной абсорбцией у нормальных людей, у пациентов с более высокой экскрецией кальция с мочой наблюдается преувеличенная кальциурическая реакция на любом уровне кишечной абсорбции.
Более того, пациенты с кальциевыми камнями имеют более высокий уровень кальция в моче по сравнению с пациентами без камней, независимо от потребления кальция из рациона.5 Кажется очевидным, что, хотя витамин D может увеличить усвоение кальция в кишечнике, вероятно, существуют и другие механизмы более значимой кальциурии, чем просто повышенная абсорбция в кишечнике.
Несмотря на приведенные выше данные, стимуляция всасывания кальция в кишечнике и более высокая экскреция кальция с мочой в результате приема витамина D не являются неизбежными из-за жестких регуляторных механизмов. Как транскрипция генов, так и ферментативная активность 1α-гидроксилазы (CYP27B1, активирующий фермент) активируются ПТГ, низким содержанием кальция и фосфата в сыворотке и пониженной регуляцией 1,25-дигидроксивитамином D3.
Кроме того, CYP24A1 (дезактивирующий фермент) активируется с помощью различных генетических и эпигенетических механизмов, вызывая деградацию 1,25-дигидроксивитамина D3, чтобы ослабить биодоступность и предотвратить гиперкальциемию. Учитывая этот механизм регуляции, возникает вопросом, почему у людей, склонных к образованию камней, даже при приеме добавок с витамином D, наблюдается повышенный уровень кальцитриола?
Генетические вариации в метаболизме витамина D у пациентов с камнями
Для ответа на этот вопрос были предложены различные механизмы, и последние данные свидетельствуют о том, что ответ может быть связан с мутациями в CYP24A1, создающими неспособность деактивировать кальцитриол (Рисунок 1), о чем свидетельствует идиопатическая инфантильная гиперкальциемия (ИИГ).10 Schlingmann с соавторами продемонстрировали, что у детей с ИИГ значительный нефрокальциноз и гиперкальциемия наблюдались в условиях подавленного сывороточного ПТГ и значительного повышения уровня 1,25-дигидроксивитамина D3 вследствие мутаций CYP24A1.
Эти мутации были также выявлены во второй когорте, которая перенесла тяжелую гиперкальциемию после приема витамина D.10 Как и ожидалось, у мышей, нокаутированных по CYP24A1, выявляется гиперкальциемия и нефрокальциноз после введения экзогенного витамина D.13 Хотя мутации CYP24A1 были выявлены у людей, склонных к образованию кальциевых камней, точная распространенность этой мутации неизвестна. Эти люди отличаются от пациентов с идиопатическим камнеобразованием низким уровнем ПТГ с повышенными значениями кальцитриола. Уровни 24, 25-дигидроксивитамина D снижены.
Развитие медицины сделало генетическое тестирование более доступным и менее дорогостоящим, что потенциально применимо для пациентов с камнями. Выявлено множество потенциально клинически значимых моногенных причин идиопатического нефролитиаза. Улучшенная диагностика посредством генотипирования уже доступна и была предложена как для диагностических, так и для терапевтических целей.14 Гетерозиготность мутаций CYP24A1 может предрасполагать к образованию камней; поэтому следует проводить скрининг с целью определения уровня 25(OH)D в сыворотке (который будет высоким) и уровней 24, 25(OH) витамина D (который будет низким), прежде чем назначать добавки с витамином D пациентам, у которых образуются камни для предупреждения обострения кальциурии. Пациенты, которым следует проводить скрининг и генетическое тестирования – это пациенты с высоким или выше среднего уровнем кальция в сыворотке и сниженным уровнем ПТГ.
Другие генетические пути могут дать более глубокое понимание взаимосвязи кальциурии с витамином D и мочекаменной болезнью. Полиморфизмы рецептора витамина D (ПРВD) могут вызывать повышенный ответ, приводящий к более высокой экскреции кальция с мочой, и исследования сцепления родственных пар выявили вариабельность аллеля витамина D у пациентов с идиопатическим формированием камней.15 Исследования, направленные на выявление однонуклеотидных полиморфизмов (ОП) ПРВD у пациентов с камнями дали смешанные результаты.16
Неоднородность исследований по таким переменным как пол, раса, воздействие ультрафиолета и образ жизни, являются заметными ограничениями. Другим геном-кандидатом, участвующим в предрасположенности к образованию кальциевых камней, является чувствительный к кальцию рецептор CaSR, кодируемый CASR. Расположенные как в почках, так и в паращитовидных железах, эти рецепторы оказывают защитное действие, противодействуя кальцификации и осаждению фосфатов кальция. Перемены в экспрессии меняют нормальный гомеостаз между водой, кальцием и фосфатом.17 Промоторы этого гена содержат чувствительные к ПРВD элементы, а агонисты рецепторов, чувствительных к кальцию, могут ингибировать кальцификацию артерий, вызванную витамином D.17
В то время как недавно методикой полногеномного поиска ассоциаций (GWAS) идентифицировано четыре новых локуса, связанных с нефролитиазом, необходимы дальнейшие исследования, направленные на определение механизмов нефролитиаза у тех, кто генетически предрасположен к камнеобразованию.18 Несмотря на обширные исследования, точные гены, ответственные за генетическую предрасположенность к камнеобразованию, остаются неизвестными.
Линия крыс с генетическим гиперкальциурическим камнеобразованием (GHS) селективно разводится для получения животных с максимальным выделением кальция с мочой и идеально подходит для изучения генетики и патофизиологии нефролитиаза. 19 У крыс GHS выделяется до 10 раз больше кальция с мочой на стандартной диете, и у них образуются камни из фосфата кальция или оксалата кальция при добавлении к их диете гидроксипролина (предшественника оксалата). Механизмом, по-видимому, является кишечная абсорбция кальция, опосредованная повышенным уровнем ПРВD.19 У крыс линии GHS также наблюдалось увеличение ПРВD как в костной, так и в почечной тканях, что обусловливает резорбцию скелета, а также неспособность резорбировать отфильтрованный кальций в процессе литогенеза. При назначении кальцитриола резорбция кости и содержание кальция в моче значительно возрастали по сравнению с контролем. Введение предшественника кальцитриола, холекальциферола, вызывало у этих крыс образование почечных камней, хотя пероральное введение кальция не вызывало такого эффекта.21 Крысы линии GHS отражают общие метаболические нарушения у пациентов с идиопатическим формированием камней, и хотя генетическая картина остается неполной, данные исследования дают дополнительное представление о сложной полигенетике, предрасполагающей человека к камнеобразованию.
В конечном итоге повышенные уровни кальцитриола усиливают кальциурию и образование камней в почках.11 Однако связь циркулирующего 25-гидроксивитамина D3 (прямого предшественника кальцитриола) с образованием камней в почках менее ясна и, возможно, более важна, поскольку является общепринятым клиническим способом измерения уровня витамина D. Мета-анализ показывает неоднозначные результаты в отношении корреляции между уровнем 25-гидроксивитамина D3 и риском литогенеза.22
Повышенное содержание циркулирующих 25-гидроксивитамина D3 и 1,25 дигидроксивитамина D3 было отмечено у пациентов с гиперкальциурическими камнями, но не у пациентов с нормокальциурическими камнями. В некоторых исследованиях было продемонстрировано повышение уровня 1,25 дигидроксивитамина D3 у пациентов с нормокальциурическими камнями по сравнению с контролем, но статистически значимо эти показатели не различались.22 Множественные генетические полиморфизмы и различия в образе жизни, вероятно, играют ключевую роль в полученных результатах приведенных выше исследований.
Отсутствие последовательного воздействия этих метаболитов витамина D подчеркивает сложность гомеостаза кальция и образования камней, поэтому необходимы дальнейшие исследования для выявления фенотипических подгрупп, которые могут подвергаться риску при приеме добавок.
Прием добавок с витамином D и риск образования камней почек
В крупнейшем на сегодняшний день исследовании связи между уровнем витамина D и образованием камней в почках были изучены три хорошо охарактеризованные когорты: мужчины в проспективном исследовании здоровья медицинских работников (ИЗМР) и женщины в исследовании здоровья медсестер (ИЗМС) I и II.6 Долгосрочное проспективное наблюдение почти 200 000 мужчин и женщин не выявило никакой связи между потреблением витамина D и риском развития камней после обработки данных методами мультивариантной статистики. Группа ИЗМС II имела тенденцию к более высокому риску камнеобразования со значением р 0,02; однако доверительный интервал был 1.0.6 Показания к приему витамина D у этих людей были неизвестны, и лишь немногие в группе употребляли витамин D в количестве более 2000 МЕ в день. Авторы пришли к выводу, что нет никакой связи между витамином D в «типичных количествах» и камнями почек.6
Предыдущие исследования в основном согласуются с этим выводом, в том числе предыдущий анализ ИЗМР.23 Этот вывод был подтвержден у более чем 2000 пациентов, у которых продемонстрировано отсутствие связи между повышенным уровнем 25-гидроксивитамина D3 и камнями и отсутствие связи между увеличением количества употребления витамина D и риском возникновения камней, хотя и с коротким периодом последующего наблюдения и низким уровнем заболеваемости.24
Большинство интервенционных исследований и метаанализов опровергают непосредственную роль витамина D в качестве причинного фактора в формировании камней при одновременном приеме кальция.25-27 Несмотря на то, что прием кальция с пищей обратно связаны с образованием кальциевых камней, поступление кальция не из пищевых продуктов несомненно связано с камнями.2
Витамин D с добавками кальция увеличивал количество камней у крыс с гиперкальциурией.21 Целевая группа по профилактическим мероприятиям США (USPSTF) нашла достаточные доказательства того, что добавки с витамином D и кальцием увеличивают частоту возникновения камней в почках.28 Этот вывод основан на данных трех рандомизированных контролируемых исследований (n = 39 659), в которых прием витамина D и кальция в течение 4-7 лет увеличивал частоту появления почечных камней; суммарная разница абсолютного риска составила 0,33% (от 0,06% до 0,60%), а суммарный доверительный интервал составил 1,18 (1,04–1,35).28
В рамках исследования Инициативы по охране здоровья женщин (WHI), у женщин в постменопаузе, принимающих 400 МЕ витамина D и 1000 мг элементарного кальция, было отмечено повышенное образование почечных камней (повышение на 1,17, 95% доверительный интервал 1,02-1,34). Хотя соотношение рисков является незначительными, большое количество женщин, принимающих добавки, делает риск клинически значимым.26 Вопрос о том, будет ли литогенез под контролем, если вместо карбоната кальция будет использоваться цитрат кальция или прием пищи с повышенным содержанием кальция,9 остается открытым.
Примечательно, что Curhan с соавторами не обнаружили никакой существенной связи между профилактическим или любым другим использованием ежедневных добавок кальция и образованием камней в почках. Авторы также предполагают, что это могло быть связано со сроками приема добавок, так как диета с повышенным содержанием кальция ограничивала литогенез.2 В другом, более свежем исследовании Malihi с соавторами (2019 год) не было продемонстрировано повышенного риска образования камней или повышения уровня кальция в сыворотке при приеме высоких доз витамина D (без кальция), с медианой наблюдения более 3 лет.29
Несмотря на результаты WHI, маловероятно, что предельное ожидаемое увеличение в сыворотке уровня 25(OH)D при 400 МЕ привело к гиперкальциемии (и последующему увеличению содержания кальция в моче), особенно с учетом относительно низких базовых уровней в этой группе.26 При исследовании пациентов с камнями и дефицитом витамина D, Leaf с соавторами обнаружили, что введение витамина D не увеличивало существенно экскрецию кальция с мочой. У некоторых пациентов наблюдалось увеличение, в то время как у других – снижение, что позволяет предположить, что добавление витамина D лучше всего контролировать в суточной моче.30
Jorhi с соавторами отметили увеличение содержания кальция в суточной моче у пациентов с камнями после приема витамина D, и хотя они не были статистически значимыми (p = 0,06), 6 из 26 пациентов, начавших с «нормального» выведения кальция, перешли на значительно более высокий уровень.31 Может ли вышеупомянутая популяция с полиморфизмами CYP24A1 или ПРВD быть исключением? Авторы предлагают то же самое, однако никакой оценки CYP24A1 или других мутаций не проводилось ни в одном исследовании. Несмотря на различия в лекарственной форме и продолжительности приема витамина D между этими двумя исследованиями, можно сделать вывод о том, что, возможно, целесообразно контролировать экскрецию кальция с мочой у пациентов с камнями, которые принимают витамин D.31
Нужно ли принимать витамин D?
Низкий уровень 25-(OH)D связан с развитием множества побочных эффектов, включая переломы, падения, сердечно-сосудистые заболевания, колоректальный рак, диабет, депрессию, снижение когнитивных функций и смерть.32 Рандомизированные исследования добавок витамина D, как правило, не подтверждают их прямую связь со всеми этими состояниями.
Что касается здоровья костей, метаанализ, изучающий добавки в бессимптомных когортах пациентов с дефицитом витамина D, выявил снижение среднего числа падений, но не уменьшение переломов; было обнаружено снижение риска смерти, но оно не было доказано при исключении исследований с участием женщин старшего возраста.32 Исследование WHI выявило небольшое увеличение МПК у бессимптомных пациентов, которые принимали добавки, но без снижения числа переломов.27
Таким образом, USPSTF не нашел достаточных доказательств, чтобы рекомендовать проведение скрининга у мужчин и женщин в пременопаузе, и не рекомендует ежедневный прием 400 МЕ или менее витамина D и 1000 мг или менее кальция для первичной профилактики бытовых переломов у мужчин и женщин в постменопаузе.28 Hansen и др. при исследовании женщин в постменопаузе с уровнем 25-(OH)D менее 30 нг/мл не обнаружили различий между плацебо, низкой или высокой дозой холекальциферола с точки зрения МПК, мышечной функции, мышечной массы или наличия падений.33 В недавнем исследовании 2019 года, которое проводилось в Университете Калгари, авторы в течение 3-х лет следили за здоровыми взрослыми и обнаружили снижение МПК, как лучевой, так и большеберцовой кости, при существенном увеличении дозы витамина D с использованием 400 МЕ в качестве точки отсчета.34
Исторически, анализы на витамин D проводились для установления его роли в метаболическом здоровье костей. Однако возможные (и широко разрекламированные) положительные эффекты витамина D вызвали интерес к его плейотропным, не связанных с костной тканью, эффектам.35 Наблюдательные исследования демонстрируют обратную зависимость между 25- (OH)D и широким спектром расстройств, а также указывают на то, что в последние годы во всем мире произошло заметное увеличение количества анализов и частоты приема добавок. При бессимптомном первичном профилактическом лечении добавка витамина D не имела положительного эффекта в отношении сердечно-сосудистых заболеваний или рака.36 Кроме того, недавний крупный систематический обзор 34 интервенционных исследований не показал никакой пользы от приема витамина D, не связанной с костной системой, хотя пожилые женщины имели небольшое снижение смертности от всех причин.37 Несмотря на то, что противоречия не были устранены, тот факт, что в многочисленных исследованиях было обнаружено небольшое преимущество добавок, делает вероятным, что низкий уровень 25- (OH) D является результатом, а не причиной плохого состояния здоровья.37
В ответ на новые данные были предприняты попытки снизить частоту тестирования пациентов. Американское общество клинической патологии выступило с инициативой «Мудрый выбор», рекомендовавшей не проводить популяционный скрининг 25-(OH) D, так как они определили, что тест не имеет никакого смысла.38 Кроме того, Мэнсон с соавторами отмечают, что уровни витамина D при его клиническом и экспериментальном применении в значительной степени основаны на неправильной интерпретации и неправильном применении эталонных значений, а также на том, что опасения по поводу «пандемии» дефицита витамина D являются необоснованными. 39 Рекомендуемое для здоровья костей минимальное содержание витамина D 20 нг на миллилитр часто используется в качестве «точки отсчета», тогда как фактически это верхний предел спектра потребностей, и большинство (97,5%) населения имеет потребность в витамине D на таком уровне или даже меньше.39 Таким образом, рутинный скрининг и прием добавок у бессимптомных пациентов, вероятно, имеют небольшую пользу и могут в теории вредить некоторым пациентам, генетически предрасположенным к образованию камней.
Лечение сниженной МПК у пациентов с почечными камнями
Симптоматическим группам населения с нетравматическими переломами, дисфункцией печени или почек или мальабсорбционными заболеваниями явно потребуется вмешательство для обеспечения здоровья костей, и пациенты с камнями не являются исключением. Действительно, мочекаменная болезнь в анамнезе и более высокая экскреция кальция с мочой предрасполагают к снижению МПК3 и независимо связаны с более высоким риском перелома запястья, как у мужчин, так и у женщин.40
Кроме того, у пациентов с мочекаменной болезнью распространенность снижения уровня витамина D была более 80% и связана с метаболическими нарушениями при лечении камней, из-за чего этой когорте пациентов особенно часто рекомендовано употреблять добавки.8 Как тогда лечить пациентов из группы риска с камнями и с остеопенией или остеопорозом?
Скрининг на мутации CYP24A1 доступен и может быть полезен; однако существуют альтернативные препараты, которые увеличивают МПК с дополнительным преимуществом в виде профилактики камнеобразования, и даже были эмпирически предложены для тех, кто находится в группе риска образования камней.41 Тиазиды хорошо известны и рекомендованы как Американской урологической ассоциацией, так и Европейской урологической ассоциацией для профилактики образования кальциевых камней с 47% -ным снижением относительного риска рецидивов, показанным в мета-анализе.42 Тиазиды увеличивают абсорбцию кальция непосредственно в дистальных канальцах и косвенно в проксимальных канальцах, уменьшая кальциурию. В результате удерживаемый кальций увеличивает МПК у мужчин со скоростью 8% и 3% в год для позвоночника и бедренных костей соответственно.43
Эти результаты были подтверждены в большом популяционном исследовании случай-контроль, включавшем более сорока тысяч пациентов в Дании, получавших лечение от гипертонии. Авторы сообщили о 17% -ном снижении частоты перелома предплечья и о 10% -ном снижении частоты любых других переломов при применении тиазида для коррекции осложнений.44 Пак и соавторы продемонстрировали аналогичные улучшения в плотности позвоночника, шейки бедра и лучевой кости при применении тиазидов с цитратом калия, что привело к практически полному прекращению образования камней.45 Тиазиды несут риск гипокалиемии, приводя к гипоцитратурии, поэтому рекомендуется добавление цитрата калия.
Гипоцитратурия чрезвычайно распространена среди пациентов с камнями, и цитрат калия независимо снижает рецидив возникновения почечного камня путем увеличения содержания цитрата и снижения экскреции кальция с мочей. Хроническая кислотная нагрузка, обычное следствие диеты с высоким содержанием белка, связана не только с литогенезом23, но и с уменьшением костной массы. 46
Jehle и соавторы в рандомизированном проспективном контролируемом исследовании женщин в постменопаузе с остеопенией продемонстрировали эффективность цитрата калия для снижения содержания кальция в моче, увеличения цитрата в моче и значительном увеличении костной массы.46 Предположительно, эти эффекты возникают при нейтрализации протонов и снижении экскреции кальция через мочу. В той же группе были представлены аналогичные результаты у пациентов пожилого возраста с остеопорозом, которым вводили цитрат калия в течение 24 месяцев, улучшая микроархитектуру кости.47 Побочные эффекты включают расстройство желудочно-кишечного тракта и диарею. Если гиперкалиемия вызывает беспокойство, тогда можно рассмотреть цитрат натрия в качестве замены; однако это не уменьшает экскрецию кальция с мочой и может увеличить риск образования камней.
Предпочтительной терапией для улучшения состояния костей является введение бисфосфоната. Это хорошо зарекомендовавший себя тип терапии остеопороза, который эффективно ингибирует резорбцию кости. В рандомизированном контролируемом исследовании Giusti и его коллег обнаружено улучшение МПК и снижение содержания кальция в суточной моче при применении алендроната при остеопорозе, связанном с повышенной экскрецией кальция с мочой. Положительное воздействие на показатели здоровья костей и уровень кальция в моче значительно усиливалось при одновременном применении тиазида.49 Бисфосфонаты давали такие же результаты у пациентов с камнями в проспективно отслеживаемой когорте при ограничении литогенной активности.50 Weisinger с соавторами продемонстрировали снижение суточной экскреции кальция с мочой при использовании бисфосфоната у 18 пациентов с гиперкальциурическим камнем, а также восстановление костного обмена и увеличение МПК поясничного отдела позвоночника. В нормокальциурической контрольной группе не наблюдалось снижения содержания кальция в моче, что свидетельствует о роли резорбции кости в литогенезе.51 Обширные исследования бисфосфонатов показывают, что они хорошо переносятся и безопасны; однако, несмотря на эти данные, существуют значительные противопоказания к их использованию. Наблюдается множество побочных эффектов, включая непереносимость со стороны желудочно-кишечного тракта, атипичные переломы бедра и остеонекроз челюсти (ОНЧ); однако они редки и их было трудно воспроизвести.52 ОНЧ уделили особое внимание, и, несмотря на выводы, содержащиеся в отчетах, причинно-следственных исследований не существует. ОНЧ чаще всего появляется при более высоких дозах, используемых при распространенном раке и множественных миеломах, с частотой менее 1 случая на 100 000 человек в год.52 Наконец, значительный эффект золедроновой кислоты при использовании с целью предотвращения переломов был также продемонстрирован у женщин с остеопенией, это гораздо большая группа, более склонная к переломам, чем женщины с остеопорозом; можно ожидать, что в этой группе также снижается содержание кальция и литогенов в моче.53
Выводы.
Наличие камней почек значительно влияет на качество жизни пациентов и стоимость его поддержания на высоком уровне. Связь камнеобразования с ожирением и диетой неоспорима. Широко распространенный скрининг на витамин D, приводящий к назначению пациентам добавок в терапевтических дозах, по-видимому, не способствовал риску образования камней в почках среди населения. Повышенный уровень кальцитриола в известных препаратах действительно повышает риск развития литогенных заболеваний, а витамин D может увеличивать количество камней у пациентов с мутациями CYP24A1.
Генетическое тестирование, хотя и может быть полезным для профилактики, недоступно или не необходимо для большей части населения мира. Доказательств пользы витамина D для взрослых, которые не подвержены риску рахита, немного, новые фармакологические препараты могут увеличить МПК при уменьшении количества эпизодов камнеобразования с минимальными и управляемыми побочными эффектами.
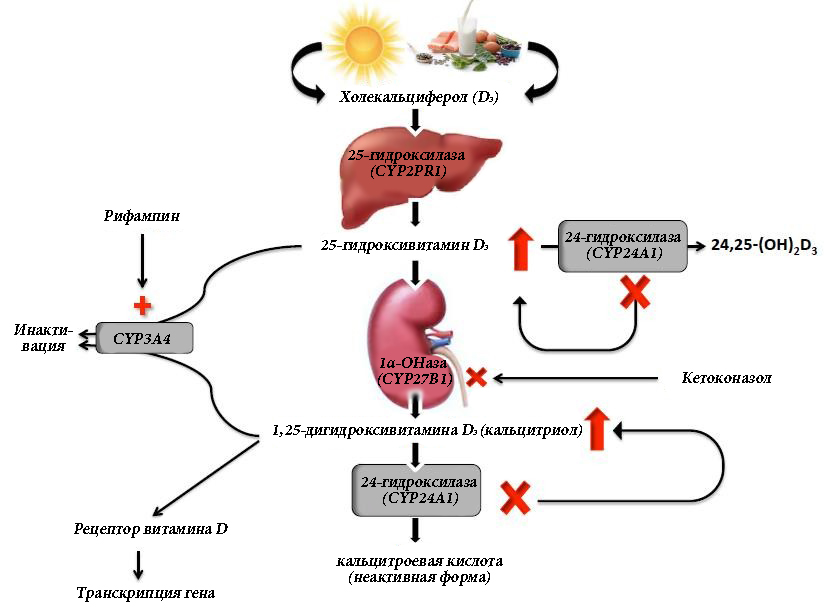
Рисунок 1. Метаболический путь витамина D в сочетании с активирующими и ингибирующими факторами. (1α-ОНаза, 1альфа-гидроксилаза; 24,25- (ОН)2D3, 24,25-дигидроксихолекальциферол)
REFERENCES
1. Scales CD, Jr., Smith AC, Hanley JM, et al. Prevalence of kidney stones in the United States. Eur Urol 2012; 62(1):160-5.
2. Curhan GC, Willett WC, Rimm EB, et al. A prospective study of dietary calcium and other nutrients and the risk of symptomatic kidney stones. New England Journal of Medicine 1993; 328(12):833-838.
3. Asplin J, Donahue S, Kinder J, et al. Urine calcium excretion predicts bone loss in idiopathic hypercalciuria. 2006; 70(8):1463-1467.
4. Lauderdale DS, Thisted RA, Wen M, et al. Bone mineral density and fracture among prevalent kidney stone cases in the Third National Health and Nutrition Examination Survey. Journal of Bone and Mineral Research 2001; 16(10):1893-1898.
5. Worcester EM, Coe FL. New insights into the pathogenesis of idiopathic hypercalciuria. Semin Nephrol 2008; 28(2):120-32.
6. Ferraro PM, Taylor EN, Gambaro G, et al. Vitamin D intake and the risk of incident kidney stones. 2017; 197(2):405-410.
7. Sattar N, Welsh P, Panarelli M, et al. Increasing requests for vitamin D measurement: costly, confusing, and without credibility. Lancet 2012; 379(9811):95-6.
8. Elkoushy MA, Sabbagh R, Unikowsky B, et al. Prevalence and metabolic abnormalities of vitamin D–inadequate patients presenting with urolithiasis to a tertiary stone clinic. Urology 2012; 79(4):781-785.
9. Levine BS, Rodman JS, Wienerman S, et al. Effect of calcium citrate supplementation on urinary calcium oxalate saturation in female stone 21 formers: implications for prevention of osteoporosis. The American journal of clinical nutrition 1994; 60(4):592-596.
10. Schlingmann KP, Kaufmann M, Weber S, et al. Mutations in CYP24A1 and idiopathic infantile hypercalcemia. N Engl J Med 2011; 365(5):410-21.
11. Taylor EN, Hoofnagle AN, Curhan GC. Calcium and phosphorus regulatory hormones and risk of incident symptomatic kidney stones. Clin J Am Soc Nephrol 2015; 10(4):667-75.
12. Breslau NA, Preminger GM, Adams BV, et al. Use of ketoconazole to probe the pathogenetic importance of 1,25-dihydroxyvitamin D in absorptive hypercalciuria. J Clin Endocrinol Metab 1992; 75(6):1446-52.
13. St-Arnaud R, Arabian A, Travers R, et al. Deficient mineralization of intramembranous bone in vitamin D-24-hydroxylase-ablated mice is due to elevated 1, 25-dihydroxyvitamin D and not to the absence of 24, 25- dihydroxyvitamin D. 2000; 141(7):2658-2666.
14. Policastro LJ, Saggi SJ, Goldfarb DS, et al. Personalized intervention in monogenic stone formers. The Journal of urology 2018; 199(3):623-632.
15. SCOTT P, OUIMET D, VALIQUETTE L, et al. Suggestive evidence for a susceptibility gene near the vitamin D receptor locus in idiopathic calcium stone formation. 1999; 10(5):1007-1013.
16. Liu W, Chen M, Li M, et al. Vitamin D receptor gene (VDR) polymorphisms and the urolithiasis risk: an updated meta-analysis based on 20 case– control studies. Urolithiasis 2014; 42(1):45-52.
17. Vezzoli G, Terranegra A, Rainone F, et al. Calcium-sensing receptor and calcium kidney stones. Journal of translational medicine 2011; 9(1):201. 22
18. Urabe Y, Tanikawa C, Takahashi A, et al. A genome-wide association study of nephrolithiasis in the Japanese population identifies novel susceptible Loci at 5q35.3, 7p14.3, and 13q14.1. PLoS Genet 2012; 8(3):e1002541.
19. Bushinsky DA, Grynpas MD, Nilsson EL, et al. Stone formation in genetic hypercalciuric rats. Kidney international 1995; 48(6):1705-1713.
20. Bushinsky DA, Asplin JR, Grynpas MD, et al. Calcium oxalate stone formation in genetic hypercalciuric stone-forming rats. Kidney international 2002; 61(3):975-987.
21. Letavernier E, Verrier C, Goussard F, et al. Calcium and vitamin D have a synergistic role in a rat model of kidney stone disease. 2016; 90(4):809- 817.
22. Hu H, Zhang J, Lu Y, et al. Association between circulating vitamin D level and urolithiasis: a systematic review and meta-analysis. 2017; 9(3):301.
23. Taylor EN, Stampfer MJ, Curhan GCJJotASoN. Dietary factors and the risk of incident kidney stones in men: new insights after 14 years of follow-up. 2004; 15(12):3225-3232.
24. Nguyen S, Baggerly L, French C, et al. 25-Hydroxyvitamin D in the range of 20 to 100 ng/mL and incidence of kidney stones. 2014; 104(9):1783- 1787.
25. Avenell A, Mak JC, O'Connell D. Vitamin D and vitamin D analogues for preventing fractures in post-menopausal women and older men. Cochrane Database Syst Rev 2014(4):Cd000227.
26. Prentice R, Pettinger M, Jackson R, et al. Health risks and benefits from calcium and vitamin D supplementation: Women's Health Initiative clinical trial and cohort study. 2013; 24(2):567-580. 23
27. Jackson RD, LaCroix AZ, Gass M, et al. Calcium plus vitamin D supplementation and the risk of fractures. N Engl J Med 2006; 354(7):669- 83.
28. Grossman DC, Curry SJ, Owens DK, et al. Vitamin D, calcium, or combined supplementation for the primary prevention of fractures in communitydwelling adults: US Preventive Services Task Force Recommendation Statement. 2018; 319(15):1592-1599.
29. Malihi Z, Lawes CM, Wu Z, et al. Monthly high-dose vitamin D supplementation does not increase kidney stone risk or serum calcium: results from a randomized controlled trial. The American journal of clinical nutrition 2019; 109(6):1578-1587.
30. Leaf DE, Korets R, Taylor EN, et al. Effect of vitamin D repletion on urinary calcium excretion among kidney stone formers. 2012:CJN. 11331111.
31. Johri N, Jaeger P, Ferraro PM, et al. Vitamin D deficiency is prevalent among idiopathic stone formers, but does correction pose any risk? 2017; 45(6):535-543.
32. LeBlanc ES, Zakher B, Daeges M, et al. Screening for vitamin d deficiency: A systematic review for the u.s. preventive services task force. Annals of Internal Medicine 2015; 162(2):109-122.
33. Hansen KE, Johnson R, Chambers KR, et al. Treatment of vitamin d insufficiency in postmenopausal women: A randomized clinical trial. JAMA Internal Medicine 2015; 175(10):1612-1621.
34. Burt LA, Billington EO, Rose MS, et al. Effect of High-Dose Vitamin D Supplementation on Volumetric Bone Density and Bone Strength: A Randomized Clinical Trial. Jama 2019; 322(8):736-745. 24
35. Caillet P, Goyer-Joos A, Viprey M, et al. Increase of vitamin D assays prescriptions and associated factors: a population-based cohort study. Sci Rep 2017; 7(1):10361.
36. Moyer VAJAoim. Vitamin, mineral, and multivitamin supplements for the primary prevention of cardiovascular disease and cancer: US Preventive Services Task Force recommendation statement. 2014; 160(8):558-564.
37. Autier P, Boniol M, Pizot C, et al. Vitamin D status and ill health: a systematic review. Lancet Diabetes Endocrinol 2014; 2(1):76-89.
38. Wisely C. American Society for Clinical Pathology: don’t perform population based screening for 25-OH-vitamin D deficiency. 2015.
39. Manson JE, Brannon PM, Rosen CJ, et al. Vitamin D Deficiency — Is There Really a Pandemic? 2016; 375(19):1817-1820.
40. Taylor EN, Feskanich D, Paik JM, et al. Nephrolithiasis and risk of incident bone fracture. The Journal of urology 2016; 195(5):1482-1486.
41. Goldfarb DS. Empiric therapy for kidney stones. Urolithiasis 2019; 47(1):107-113.
42. Fink HA, Wilt TJ, Eidman KE, et al. Medical management to prevent recurrent nephrolithiasis in adults: a systematic review for an American College of Physicians Clinical Guideline. Annals of internal medicine 2013; 158(7):535-543.
43. Adams JS, Song CF, Kantorovich V. Rapid Recovery of Bone Mass in Hypercalciuric, Osteoporotic Men Treated with Hydrochlorothiazide. Annals of Internal Medicine 1999; 130(8):658-660.
44. Rejnmark L, Vestergaard P, Mosekilde L. Reduced fracture risk in users of thiazide diuretics. Calcified tissue international 2005; 76(3):167-175. 25
45. Pak CY, Heller HJ, Pearle MS, et al. Prevention of stone formation and bone loss in absorptive hypercalciuria by combined dietary and pharmacological interventions. J Urol 2003; 169(2):465-9.
46. Jehle S, Zanetti A, Muser J, et al. Partial neutralization of the acidogenic Western diet with potassium citrate increases bone mass in postmenopausal women with osteopenia. J Am Soc Nephrol 2006; 17(11):3213-22.
47. Jehle S, Hulter HN, Krapf R. Effect of potassium citrate on bone density, microarchitecture, and fracture risk in healthy older adults without osteoporosis: a randomized controlled trial. J Clin Endocrinol Metab 2013; 98(1):207-17.
48. Russell R, Watts N, Ebetino F, et al. Mechanisms of action of bisphosphonates: similarities and differences and their potential influence on clinical efficacy. 2008; 19(6):733-759.
49. Giusti A, Barone A, Pioli G, et al. Alendronate and indapamide alone or in combination in the management of hypercalciuria associated with osteoporosis: a randomized controlled trial of two drugs and three treatments. Nephrol Dial Transplant 2009; 24(5):1472-7.
50. Prochaska M, Taylor E, Vaidya A, et al. Low Bone Density and Bisphosphonate Use and the Risk of Kidney Stones. 2017:CJN. 01420217.
51. Weisinger J, Alonzo E, Machado C, et al. Role of bones in the physiopathology of idiopathic hypercalciuria: effect of aminobisphosphonate alendronate. Medicina 1997; 57:45-48. 26
52. Pazianas M, Cooper C, Ebetino FH, et al. Long-term treatment with bisphosphonates and their safety in postmenopausal osteoporosis. Ther Clin Risk Manag 2010; 6:325-43.
53. Reid IR, Horne AM, Mihov B, et al. Fracture prevention with zoledronate
in older women with osteopenia. New England Journal of Medicine 2018;
379(25):2407-2416.
